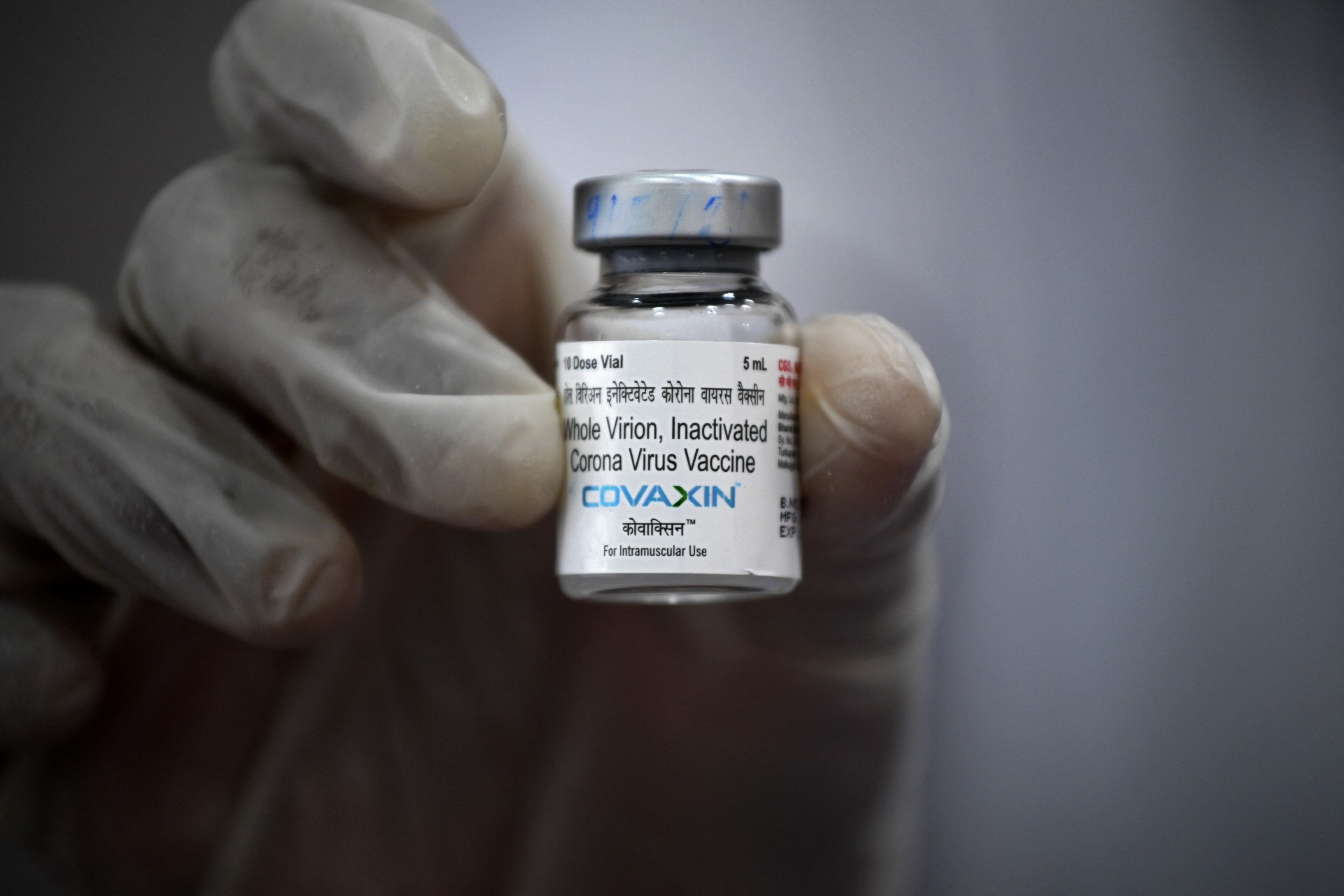
Anvisa recebeu o pedido de uso emergencial em caráter experimental da vacina CovaxinFoto: Sergio Lima
Anvisa recebe pedido de uso emergencial para vacina Covaxin
A solicitação é da empresa Precisa Comercialização de Medicamentos LTDA
A Agência Nacional de Vigilância Sanitária (Anvisa) recebeu, no início desta terça-feira, 29, o pedido de uso emergencial em caráter experimental da vacina Covaxin. A solicitação é da empresa Precisa Comercialização de Medicamentos LTDA. A Anvisa informou que iniciou a triagem dos documentos presentes no pedido.
"As primeiras 24 horas serão utilizadas para fazer uma triagem do processo e verificar se os documentos necessários para avaliação estão disponíveis. Se houver informações importantes faltando, a Anvisa pode solicitar as informações adicionais ao laboratório", esclareceu o órgão regulador.
Publicidade
Análise e prazo
Para sua avaliação, a Anvisa vai utilizar as informações apresentadas junto com o pedido e também as informações encaminhadas anteriormente por meio da submissão contínua.
Publicidade
De acordo com a Anvisa, a análise do pedido de uso emergencial é feita por uma equipe multidisciplinar que envolve especialistas das áreas de registro, monitoramento e inspeção de medicamentos. A equipe vem atuando de forma integrada em todos os processos de avaliação de medicamentos e vacinas para combate à Covid-19.
De acordo com a resolução RDC 475/2021, que regulamenta o uso emergencial de vacinas, o prazo de análise do pedido pode ser sete ou 30 dias, a depender do caso específico.
Publicidade
Pela norma, o prazo de avaliação será de sete dias quando houver desenvolvimento clínico da vacina no Brasil ou quando o relatório ou parecer técnico emitido pela autoridade sanitária estrangeira seja capaz de comprovar que a vacina atende aos padrões de qualidade, de eficácia e de segurança estabelecidos pela OMS ou pelo ICH e pelo PIC/S.
Porém, o prazo será de 30 dias quando ausente o desenvolvimento clínico da vacina no Brasil ou quando o relatório ou parecer técnico emitido pela autoridade sanitária estrangeira não for capaz de comprovar que vacina atende aos padrões de qualidade, de eficácia e de segurança estabelecidos pela OMS ou pelo ICH e pelo PIC/S.
Publicidade
O prazo de avaliação do pedido de uso emergencial não considera o tempo do processo em status de exigência técnica, que é quando o laboratório precisa responder questões técnicas feitas pela Agência dentro do processo.


















Os comentários não representam a opinião do jornal e são de responsabilidade do autor.